Krew, tkanki, komórki i narządy są wykorzystywane w wielu terapiach medycznych. Terapie te mogą uratować życie (np. transfuzja krwi w przypadku urazu), poprawić jakość życia (np. przeszczep nerki), a nawet przyczynić się do powstania nowego życia (np. gamety i zapłodnienie in vitro).
Jednak mimo tych korzyści stosowanie substancji pochodzenia ludzkiego wiąże się również z ryzykiem, zwłaszcza ryzykiem przenoszenia chorób. Dlatego Komisja Europejska ustanowiła wysokie standardy jakości i bezpieczeństwa substancji pochodzenia ludzkiego, zgodnie z art. 168 ust. 4 lit. a) Traktatu o funkcjonowaniu Unii Europejskiej.
W tym celu podejmuje szereg działań, m.in.:
- opracowuje prawodawstwo oraz wytyczne
- pomaga władzom krajowym w ich wdrażaniu
- monitoruje i wspiera realizowanie projektów.
Celem nadrzędnym jest ochrona obywateli.
Działania w związku z pandemią COVID-19
Pandemia COVID-19 stanowiła wyzwanie dla zdrowia publicznego. W celu lepszej i skoordynowanej reakcji na pandemię:
- Komisja wspierała placówki służby krwi w celu zwiększenia pobierania osocza ozdrowieńców COVID-19
- Europejskie Centrum ds. Zapobiegania i Kontroli Chorób (ECDC) opublikowało aktualizację wytycznych dotyczących COVID-19 i substancji pochodzenia ludzkiego
- DG SANTE opublikowała wytyczne dotyczące pobierania i transfuzji osocza ozdrowieńców COVID-19
- Komisja Europejska wyjaśniła, że substancje pochodzenia ludzkiego uznaje się za podstawowe towary/usługi, w przypadku których swobodny przepływ w UE ma zasadnicze znaczenie.
Organizacja sektora
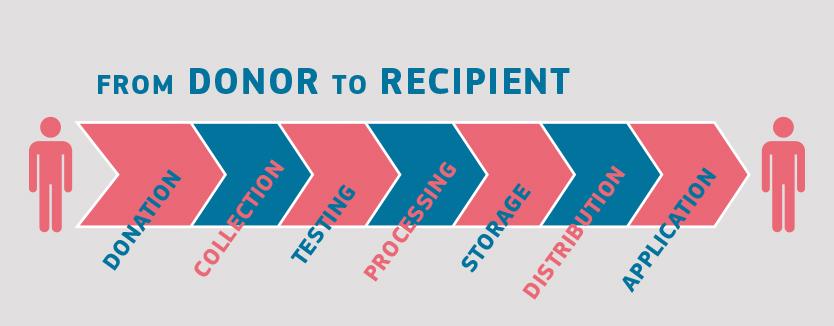
Chociaż dawcy i potencjalni biorcy kliniczni krwi, tkanek, komórek i narządów są różni, postępowanie z większością substancji pochodzenia ludzkiego odbywa się w podobny sposób. Proces rozpoczyna się od dawstwa, a kończy na zastosowaniu klinicznym. Pośrednie etapy obejmują: pobieranie, przetwarzanie i dystrybucję substancji pochodzenia ludzkiego, a także badanie dawcy oraz często przechowywanie (w szczególności w przypadku krwi, tkanek i komórek). Wszystkie te czynności odbywają się w specjalistycznych placówkach medycznych.
Zmiany w przepisach UE dotyczących krwi, tkanek i komórek
W następstwie oceny przepisów UE dotyczących krwi, tkanek i komórek, opublikowanej w 2019 r., Komisja planuje zaproponować zmiany w tych przepisach drugim kwartale 2022 r.
Współpraca
Komisja Europejska współpracuje ściśle z organami eksperckimi, takimi jak Rada Europy (RE) oraz Europejskie Centrum ds. Zapobiegania i Kontroli Chorób (ECDC), podczas prac nad praktycznymi wytycznymi wspierającymi placówki służby krwi we wdrażaniu tych wiążących ram legislacyjnych.
Finansowanie działań
Aby uzupełnić regularną pracę właściwych organów, Komisja Europejska zapewnia finansowanie działań w dziedzinie substancji pochodzenia ludzkiego.
Opieka zdrowotna leży w gestii krajów, dlatego wszystkie decyzje dotyczące substancji pochodzenia ludzkiego podejmowane są na poziomie krajowym. Komisja nie ingeruje w te decyzje, które mogą różnić się w poszczególnych krajach. Jednak praktyki dozwolone i zatwierdzone przez kraje UE muszą być zgodne z unijnymi wymogami prawnymi w zakresie bezpieczeństwa i jakości. Organy krajowe mogą zdecydować się na wprowadzenie lokalnych, bardziej rygorystycznych wymogów dotyczących bezpieczeństwa i jakości, na przykład dodatkowe analizy laboratoryjne w przypadku wybuchu lokalnego ogniska wysoce zakaźnej choroby.
Wytyczne
Rada Europy regularnie przeprowadza przeglądy wymagań technicznych i aktualizuje je w swoich publikacjach:
- „Przygotowanie, wykorzystanie i gwarancja jakości składników krwi – przewodnik”
- „Przewodnik dobrych praktyk dla placówek służby krwi”
- „Wytyczne dotyczące jakości i bezpieczeństwa tkanek i komórek przeznaczonych do stosowania u ludzi”.
Ponadto przygotowuje ona wytyczne ad hoc dotyczące innych zagadnień związanych z bezpieczeństwem i jakością substancji pochodzenia ludzkiego.
ECDC przygotowuje oceny ryzyka i plany gotowości za każdym razem, gdy ogniska epidemiologiczne są istotne z punktu widzenia zapotrzebowania na krew, tkanki, komórki i organy. Ostatnio ECDC przedstawiło dane na temat:





