Darovaná krev, tkáně, buňky a orgány se používají při řadě různých lékařských zákroků.
Léčba využívající tyto materiály lidského původu pomáhá zachraňovat životy (např. transfúze krve), zlepšuje kvalitu života (např. transplantace ledviny) a také pomáhá život vytvářet (gamety a oplodnění in vitro).
I přes své výhody vykazuje používání materiálů lidského původu jistá rizika, zejména riziko přenosu onemocnění.
Evropská komise se těmito riziky zabývá v rámci svého mandátu, kdy je jejím úkolem stanovit vysoké standardy kvality a bezpečnosti pro látky lidského původu (čl. 168 odst. 4 písm. a) Smlouvy o fungování EU).
Za tímto účelem provádí řadu činností:
- navrhování právních předpisů a vypracování pokynů
- pomoc vnitrostátním orgánům při jejich provádění
- činnost v oblasti vigilance a podpory projektů
Hlavním cílem je chránit zdraví občanů.
Nová pravidla EU týkající se látek lidského původu
Dne 24. dubna 2024 schválil Evropský parlament nové nařízení o standardech jakosti a bezpečnosti látek lidského původu určených k použití u člověka.
Organizace odvětví
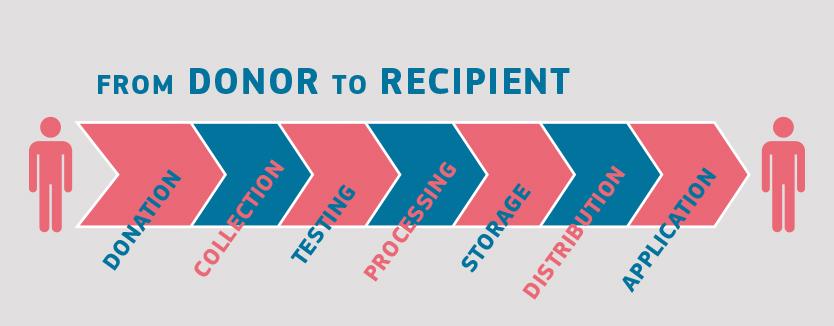
Přestože každý dárce i případný klinický příjemce krve, tkáně, buněk či orgánů je z řady hledisek jedinečný, postupy uplatňované na většinu materiálů lidského původu jsou podobné. Všechny začínají darováním, končí klinickým použitím a obnášejí například odběr, zpracování a distribuci, dále vyšetření dárce a často také skladování (zejména u krve a krevních derivátů, tkání a buněk).
Tyto dílčí kroky se odehrávají ve specializovaných zdravotnických zařízeních.
Spolupráce
Evropská komise úzce spolupracuje s odbornými institucemi, jako je Rada Evropy (RE) a Evropské středisko pro prevenci a kontrolu nemocí (ECDC), na přípravě praktických pokynů, které pomohou transfuzním zařízením s prováděním tohoto závazného právního rámce.
Financování akcí
Kromě běžných pracovních povinností příslušného orgánu poskytuje Evropská komise finanční prostředky na akce týkající se problematiky látek lidského původu.
Vzhledem k tomu, že zdravotní péče zůstává i nadále v kompetenci členských států, rozhodnutí spojená s povolováním postupů týkajících se látek lidského původu jsou přijímána na vnitrostátní úrovni. Komise do těchto rozhodnutí nezasahuje a rozhodnutí se mohou v různých státech lišit.
Jakmile jsou však postupy na úrovni členských států EU povoleny a schváleny, je nutné je organizovat v souladu s právními požadavky EU na bezpečnost a kvalitu.
Orgány členských států mohou na vnitrostátní úrovni své požadavky na bezpečnost a kvalitu zpřísnit nad rámec požadavků EU – mohou například nařídit dodatečné laboratorní testování v reakci na místní výskyt ohniska vysoce infekční nákazy.
Opatření proti šíření covidu-19
Koronavirová pandemie představovala pro sektor veřejného zdraví velkou výzvu. V zájmu lepší a koordinované reakce na šíření nákazy:
- Evropská komise podporovala transfúzní služby při zvýšení odběru rekonvalescentní plazmy pro léčbu covidu-19
- Evropské středisko pro prevenci a kontrolu nemocí (ECDC) zveřejnilo aktualizaci svých pokynů týkajících se onemocnění koronavirem a látek lidského původu
- GŘ SANTE zveřejnilo pokyny týkající se odběru a transfúze rekonvalescentní plazmy
- Evropská komise potvrdila, že látky lidského původu jsou považovány za základní zboží/služby, pro něž je volný oběh v EU klíčový
Obecné pokyny
Rada Evropy pravidelně přezkoumává a aktualizuje technické požadavky obsažené v těchto dokumentech:
- Příručka pro přípravu, používání a zajišťování kvality krevních složek
- Pokyny pro správnou praxi transfuzních zařízení
- Příručka o kvalitě a bezpečnosti tkání a buněk pro použití u lidských pacientů
Kromě toho připravuje ad hoc pokyny k různým tématům souvisejícím s bezpečností a kvalitou látek lidského původu.
Evropské středisko pro prevenci a kontrolu nemocí (ECDC) zpracovává posouzení rizik a plány připravenosti v případech, kdy existuje v souvislosti s vypuknutím nějaké epidemie riziko pro používání krevního materiálu, tkáně, buněk a orgánů. Nejnověji ECDC poskytlo informace o těchto tématech:





