Un amplio abanico de terapias médicas recurren a la utilización de sangre, tejidos, células y órganos.
Los tratamientos basados en estas sustancias de origen humano permiten salvar vidas (por ejemplo, mediante la transfusión de sangre en caso de traumatismo), mejorar la calidad de vida (gracias a los trasplantes de riñón u otros órganos) e, incluso, contribuir a la concepción (gametos y fecundación in vitro).
A pesar de estas ventajas, el uso de sustancias de origen humano presenta riesgos, en particular de transmisión de enfermedades.
La Comisión Europea contribuye a controlar estos riesgos en virtud del mandato de establecer altos niveles de calidad y seguridad de las sustancias de origen humano que le confiere el artículo 168, apartado 4, letra a), del Tratado de Funcionamiento de la Unión Europea.
A tal fin, lleva a cabo una serie de actividades, entre las que se incluyen:
- elaboración de legislación y desarrollo de orientaciones
- ayudar a las autoridades nacionales en su aplicación
- actividades de vigilancia y apoyo a proyectos
El objetivo último es proteger a los ciudadanos.
Nuevas normas de la UE sobre sustancias de origen humano
El 27 de mayo de 2024, el Consejo adoptó el nuevo Reglamento sobre las normas de calidad y seguridad de las sustancias de origen humano destinadas a su aplicación en el ser humano.
Organización del sector
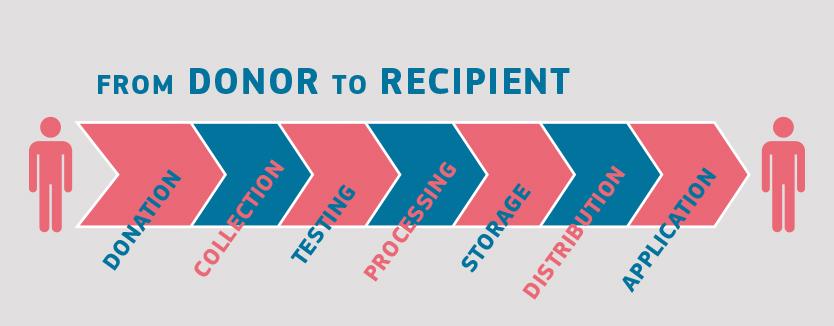
Aunque los donantes y los posibles receptores clínicos de sangre, tejidos, células y órganos son diferentes, la mayoría de las sustancias de origen humano siguen el mismo flujo de procesamiento: donación inicial, seguida de las fases de recogida, procesamiento y distribución, hasta culminar en la aplicación clínica. A esto se suman la realización de pruebas sobre los donantes y, con frecuencia, el almacenamiento de estas sustancias (en particular, en el caso de la sangre, los tejidos y las células).
Estas actividades se llevan a cabo en establecimientos médicos especializados.
Cooperación
La Comisión Europea colabora estrechamente con órganos especializados como el Consejo de Europa y el Centro Europeo para la Prevención y el Control de las Enfermedades en la elaboración de directrices prácticas que faciliten la aplicación de este marco legislativo vinculante en los centros de transfusión sanguínea.
Financiación de acciones
Además del trabajo habitual de la autoridad competente, la Comisión Europea financia acciones en el ámbito de las sustancias de origen humano.
Sin embargo, en la medida en que la asistencia sanitaria sigue siendo una competencia de los Estados miembros, las decisiones sobre las prácticas autorizadas para estas sustancias se toman a nivel nacional. La Comisión no interviene en esas decisiones, que pueden variar de un país a otro.
No obstante, una vez que los países de la UE autorizan sus prácticas, estas deben organizarse en consonancia con los requisitos legales de seguridad y calidad aplicables en la Unión.
Por su parte, las autoridades nacionales pueden optar por aplicar requisitos más estrictos de seguridad y calidad, como, por ejemplo, pruebas de laboratorio adicionales en respuesta a un brote epidemiológico local de una enfermedad altamente contagiosa.
Medidas contra la pandemia de COVID-19
La pandemia de COVID-19 representa un reto para la salud pública. Con el fin de dar una respuesta mejor y coordinada al brote:
- la Comisión Europea ayudó a los servicios de transfusión sanguínea a aumentar la extracción de plasma de convaleciente de COVID-19.
- El ECDC ha publicado una actualización de sus orientaciones sobre la COVID-19 y las sustancias de origen humano.
- La DG SANTE ha publicado orientaciones sobre la recogida y transfusión de plasma de convaleciente de COVID-19.
- La Comisión Europea ha aclarado que las sustancias de origen humano se consideran bienes o servicios esenciales para los que la libre circulación en la UE resulta crucial.
Directrices
El Consejo de Europa revisa y actualiza periódicamente los requisitos técnicos en sus documentos siguientes:
- Guía para la preparación, uso y control de la calidad de los componentes sanguíneos
- Directrices de buenas prácticas para los centros de transfusión sanguínea
- Guía sobre calidad y seguridad de los tejidos y las células para su aplicación en el ser humano
Además, elabora directrices ad hoc sobre distintos temas relacionados con la seguridad y la calidad de las sustancias de origen humano.
El Centro Europeo para la Prevención y el Control de las Enfermedades elabora evaluaciones de riesgo y planes de preparación cuando los brotes epidemiológicos afectan a la sangre, los tejidos, las células y los órganos. En los últimos tiempos, se ha pronunciado sobre estos temas:





