Brugen af vævs- og cellebaserede behandlinger stiger både i antal og hyppighed takket være markante fremskridt inden for bioteknologien.
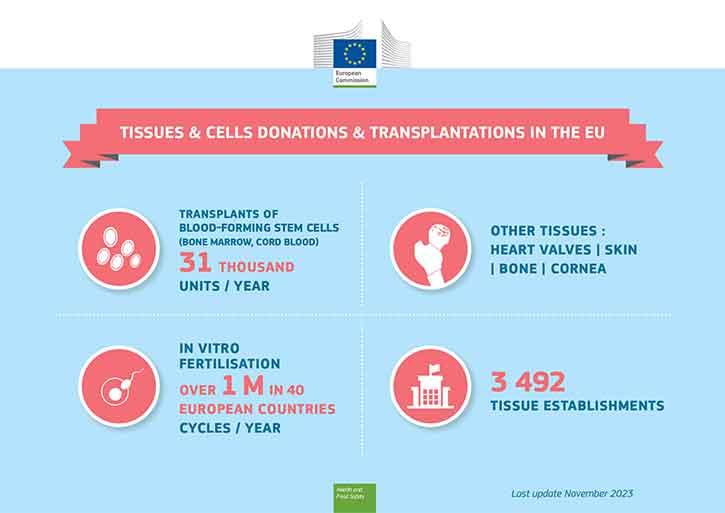
Bloddannende stamceller fra knoglemarvsdonorer (eller navlestrengsblod) transplanteres til patienter med blodkræft, og kønsceller anvendes til reagensglasbefrugtning. Begge disse velkendte behandlingsformer er baseret på brugen af menneskelige celler. Af andre værdifulde anvendelser af menneskeligt væv kan nævnes hudtransplantation til brandsårsofre og hornhindetransplantation, der kan give patienten synet tilbage.
Knoglemarv (hæmatopoietiske stamceller) og kønsceller (sæd- og ægceller) til reagensglasbefrugtning kan doneres af levende donorer, mens erstatningsvæv (såsom hud, knogler, hornhinder og hjerteklapper) først kan doneres efter donorens død.
Europa-Kommissionen yder støtte til initiativer på området substanser af menneskelig oprindelse, hovedsagelig i form af projekter og indsatser i fællesskab med nationale myndigheder. Projekterne har normalt til formål at understøtte EU's politik angående sikkerhed og kvalitet, men kan også fremme andre politiske prioriteter som f.eks. at forbedre tilgængeligheden af stoffer af menneskelig oprindelse eller effektivisere de systemer, der sørger for donation og udbud.
Lovgivning
De lovgivningsmæssige rammer, der definerer kvalitets- og sikkerhedsstandarder for væv og celler er fastlagt i direktiv 2004/23/EF, også kaldet direktivet om væv og celler. Det blev vedtaget i 2004 af Europa-Parlamentet og Rådet og omfatter alle led i transplantationsprocessen fra donation over udtagning, testning, behandling, præservering og opbevaring og til distribution.
For at hjælpe med gennemførelsen af dette direktiv har Europa-Kommissionen i tæt samarbejde med medlemslandene foreslået og vedtaget følgende gennemførelsesretsakter:
- Kommissionens direktiv 2006/17/EF om visse tekniske krav til donation, udtagning og testning af humane væv og celler
- Kommissionens direktiv 2006/86/EF om krav til sporbarhed, indberetning af alvorlige bivirkninger og uønskede hændelser og visse tekniske krav til kodning, behandling, præservering, opbevaring og distribution af humane væv og celler
- Kommissionens direktiv 2015/565 om ændring af direktiv 2006/86/EF for så vidt angår visse tekniske krav til kodning af humane væv og celler
- Kommissionens direktiv 2015/566 om gennemførelse af direktiv 2004/23/EF for så vidt angår procedurerne til kontrol af tilsvarende kvalitets- og sikkerhedsstandarder for importerede væv og celler
Kommissionens afgørelse 2010/453/EU, Kommissionens direktiv 2012/39/EU og Kommissionens afgørelse C(2015) 4460 omhandler en række yderligere specifikke forhold.
Det er vigtigt at bemærke, at EU-landene altid kan altid vælge at anvende strengere regler for kvaliteten af og sikkerheden ved væv og celler, end dem der er fastsat i de ovennævnte direktiver og afgørelser.
Efter en evaluering af EU-lovgivningen om blod og væv og celler, der blev offentliggjort i 2019, foreslog Kommissionen en revision af denne lovgivning, som blev vedtaget den 14. juli 2022.
Koordinering
De nationale kompetente myndigheder har ansvaret for gennemførelsen af EU-lovgivningen. Europa-Kommissionen afholder regelmæssige møder med dem for at lette kommunikationen, udveksle bedste praksis og nå frem til en fælles forståelse af, hvordan direktiverne skal gennemføres. På basis af periodiske spørgeundersøgelser, som besvares af de kompetente myndigheder, kan Kommissionen udarbejde statusrapporter om gennemførelsen af lovgivningen.





