El recurso a tratamientos médicos basados en tejidos y células es cada vez más frecuente gracias a los importantes avances en el ámbito de la biotecnología.
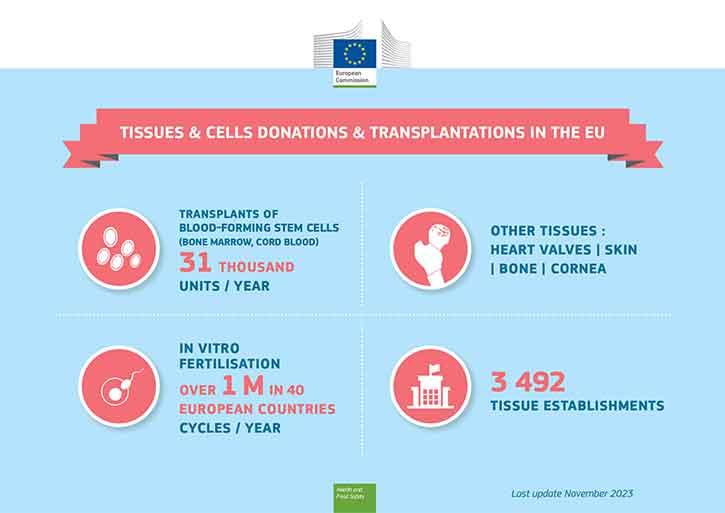
Las células madre hematopoyéticas se pueden trasplantar desde los donantes de médula ósea (o de la sangre del cordón umbilical) a los pacientes con cáncer de sangre, mientras que los gametos se utilizan para la fertilización in vitro. Ambas son terapias médicas bien implantadas que utilizan células humanas. Entre otros usos valiosísimos de los tejidos humanos cabe destacar los injertos de piel para las víctimas de quemaduras y los trasplantes de córnea para recuperar la vista.
La médula ósea (células madre hematopoyéticas) y los gametos (esperma, óvulos) para fecundación in vitro deben proceder de donantes vivos, mientras que los tejidos de sustitución (piel, huesos, córneas o válvulas cardíacas) pueden ser donados después del fallecimiento.
La Comisión Europea financia acciones en el ámbito de las sustancias de origen humano, principalmente a través de proyectos o acciones conjuntas con las autoridades nacionales. Las acciones tienen por objeto apoyar el mandato de la UE en materia de seguridad y calidad, pero también pueden servir para fomentar otras prioridades programáticas, como la mejora de la disponibilidad de las SoHO o la eficiencia de los sistemas de salud que apoyan la donación y el suministro.
Legislación
El marco jurídico que define las normas de calidad y seguridad aplicables a los tejidos y las células se establece en la Directiva 2004/23/CE, también conocida como Directiva sobre tejidos y células, adoptada en 2004 por el Parlamento Europeo y el Consejo, que cubre todas las etapas del proceso de trasplante: donación, obtención, evaluación, procesamiento, preservación, almacenamiento y distribución.
Para facilitar la aplicación de este texto principal, la Comisión propuso y adoptó, en estrecha colaboración con los países de la UE, las siguientes directivas de ejecución:
- Directiva 2006/17/CE de la Comisión sobre determinados requisitos técnicos para la donación, la obtención y la evaluación de células y tejidos humanos
- Directiva 2006/86/CE de la Comisión sobre los requisitos de trazabilidad, la notificación de las reacciones y los efectos adversos graves y determinados requisitos técnicos para la codificación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos
- Directiva (UE) 2015/565 de la Comisión por la que se modifica la Directiva 2006/86/CE en lo relativo a determinados requisitos técnicos para la codificación de células y tejidos humanos
- Directiva (UE) 2015/566 de la Comisión por la que se aplica la Directiva 2004/23/CE en lo que se refiere a los procedimientos de verificación de la equivalencia de las normas de calidad y seguridad de las células y los tejidos importados
La Decisión de la Comisión 2010/453/UE, la Directiva 2012/39/UE de la Comisión y la Decisión C(2015) 4460 de la Comisión se ocupan de otros aspectos concretos.
Conviene señalar que los países de la UE siempre pueden optar por aplicar a la calidad y la seguridad de las células y los tejidos unas normas más estrictas que las indicadas.
Como seguimiento de la evaluación de la legislación de la UE sobre sangre y tejidos y células, publicada en 2019, la Comisión propuso una revisión de dicha legislación, que se adoptó el 14 de julio de 2022.
Coordinación
Las autoridades nacionales competentes son responsables de la aplicación de los requisitos que establece la legislación de la UE. La Comisión Europea organiza reuniones periódicas con ellas para facilitar la comunicación, intercambiar buenas prácticas y llegar a un entendimiento común sobre la aplicación de las Directivas. Las encuestas periódicas, a cargo de las autoridades nacionales competentes, permiten a la Comisión elaborar informes sobre la aplicación de la legislación.





