Het gebruik van weefsels en cellen voor medische behandelingen neemt in aantal en frequentie toe dankzij aanzienlijke vooruitgang in de biotechnologie.
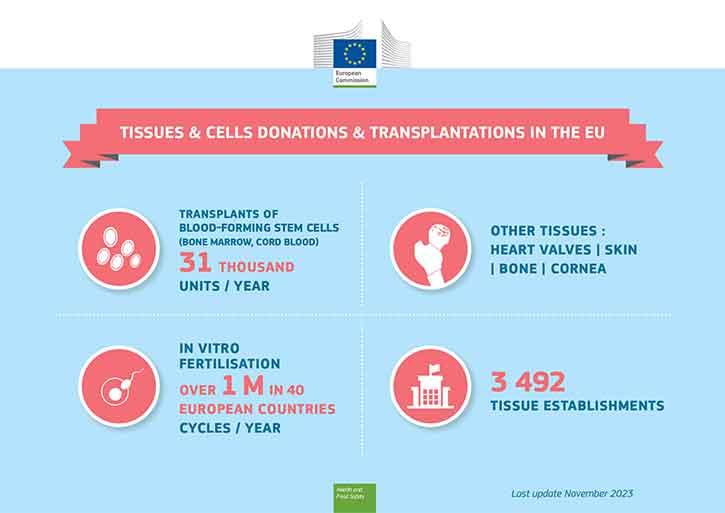
Stamcellen die zich tot bloedcellen ontwikkelen, worden van beenmergdonoren (of uit navelstrengbloed) naar patiënten met bloedkanker getransplanteerd en eicellen en zaadcellen worden voor in-vitrofertilisatie (IVF) gebruikt. Het zijn bekende medische therapieën waarbij van menselijke cellen wordt gebruikgemaakt. Andere waardevolle toepassingen met menselijke weefsels zijn o.a. huidtransplantatie voor mensen met brandwonden of hoornvliestransplantatie om mensen weer te laten zien.
Beenmerg/stamcellen en geslachtscellen (sperma- en eicellen) kunnen door levende donoren worden gedoneerd, terwijl vervangende weefsels (zoals huid, botweefsel, hoornvliezen of hartkleppen) na overlijden kunnen worden gedoneerd.
De Europese Commissie financiert acties op het gebied van stoffen van menselijke oorsprong (SoHO) vooral in de vorm van projecten en gezamenlijke acties met de nationale autoriteiten. De acties moeten het EU-mandaat voor kwaliteit en veiligheid ondersteunen, maar kunnen ook andere beleidsprioriteiten bevorderen, zoals de verbetering van de beschikbaarheid van SoHO en de efficiëntie van de gezondheidsstelsels die het doneren en leveren van weefsel en cellen ondersteunen.
Wetgeving
Het rechtskader met de veiligheids- en kwaliteitsnormen voor weefsels en cellen is vastgesteld in Richtlijn 2004/23/EG van het Europees Parlement en de Raad uit 2004, de zogenaamde “Europese richtlijn weefsels en cellen”. Daarbij komen alle stappen van het transplantatieproces aan bod: van het doneren, verkrijgen en testen tot het verwerken, conserveren, opslaan en distribueren van menselijke weefsels en cellen.
Om deze basisrichtlijn beter te kunnen uitvoeren, heeft de Commissie in nauwe samenwerking met de EU-lidstaten de volgende uitvoeringsrichtlijnen vastgesteld:
- Richtlijn 2006/17/EG van de Commissie betreffende bepaalde technische voorschriften voor het doneren, verkrijgen en testen van menselijke weefsels en cellen
- Richtlijn 2006/86/EG van de Commissie betreffende de traceerbaarheidsvereisten, de melding van ernstige bijwerkingen en ernstige ongewenste voorvallen en bepaalde technische voorschriften voor het coderen, bewerken, preserveren, bewaren en distribueren van menselijke weefsels en cellen
- Richtlijn 2015/565 van de Commissie tot wijziging van Richtlijn 2006/86/EG betreffende bepaalde technische voorschriften voor het coderen van menselijke weefsels en cellen
- Richtlijn 2004/566 van de Commissie tot uitvoering van Richtlijn 2004/23/EG aangaande de procedures om na te gaan of er sprake is van gelijkwaardige kwaliteits- en veiligheidsnormen voor ingevoerde weefsels en cellen
Besluit 2010/453/EG van de Commissie, Richtlijn 2012/39/EU van de Commissie en Besluit C(2015) 4460 van de Commissie gaan over enkele andere specifieke aspecten.
De EU-landen mogen altijd strengere regels dan de bovenvermelde regels toepassen om de kwaliteit en de veiligheid van weefsels en cellen te waarborgen.
Na een evaluatie van de EU-wetgeving inzake bloed, weefsels en cellen uit 2019 heeft de Commissie een herziening van deze wetgeving voorgesteld, die op 14 juli 2022 is goedgekeurd.
Coördinatie
De nationale bevoegde autoriteiten zijn verantwoordelijk voor de toepassing van de EU-wetgeving. De Europese Commissie organiseert regelmatig bijeenkomsten met hen om de communicatie te vergemakkelijken, goede praktijken uit te wisselen en een consensus over de uitvoering van de richtlijnen te bereiken. De Commissie stelt verslagen op over de uitvoering van de wetgeving op grond van periodieke enquêtes door de bevoegde autoriteiten.





