L'utilizzo di cure mediche basate su tessuti o cellule sta aumentando, sia per numero che per frequenza, grazie ai notevoli progressi nelle biotecnologie.
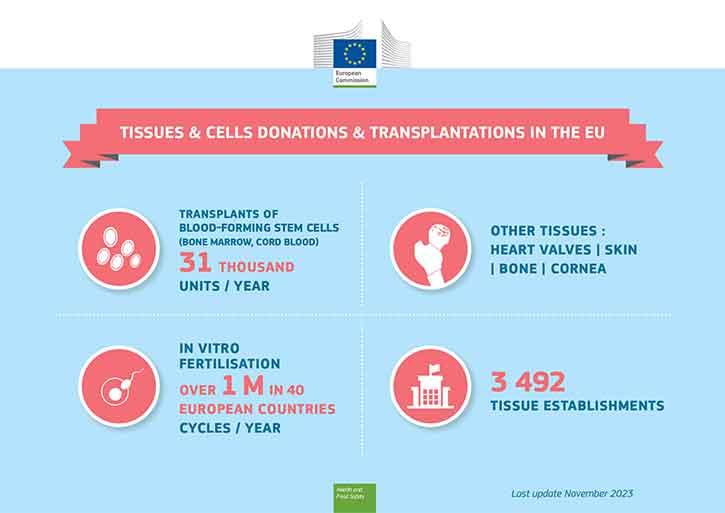
Le cellule staminali ematopoietiche vengono trapiantate da donatori di midollo osseo (o di sangue cordonale) a pazienti con un tumore del sangue, mentre i gameti vengono utilizzati per la fecondazione in vitro. Entrambe sono terapie mediche molto note che utilizzano cellule umane. Altri utilizzi inestimabili di tessuti umani sono il trapianto cutaneo per gli ustionati o il trapianto di cornea per ridare la vista.
Il midollo osseo (cellule staminali ematopoietiche) e i gameti (sperma, ovociti) per la fecondazione in vitro possono essere donati da donatori viventi, mentre i tessuti di sostituzione (come pelle, ossa, cornea, valvole cardiache) possono essere donati dopo il decesso.
Nel campo delle sostanze di origine umana, la Commissione europea eroga finanziamenti prevalentemente per progetti o azioni comuni con le autorità nazionali. Le azioni puntano a sostenere il mandato dell'UE in materia di sicurezza e qualità, ma possono anche promuovere altre priorità strategiche, come migliorare la disponibilità di sostanze di origine umana o l'efficienza dei sistemi sanitari che sostengono la donazione e l'approvvigionamento.
Normativa
Il quadro giuridico che definisce le norme di qualità e di sicurezza per i tessuti e le cellule è fissato dalla direttiva 2004/23/CE, nota anche come "direttiva europea sui tessuti e sulle cellule", adottata nel 2004 dal Parlamento europeo e dal Consiglio europeo. La direttiva riguarda tutte le fasi del processo di un trapianto: dalla donazione, al reperimento, al controllo, alla lavorazione, alla conservazione e allo stoccaggio, fino alla distribuzione.
Per contribuire all'attuazione di questo atto di base, la Commissione ha proposto e adottato, in stretta collaborazione con i paesi dell'UE, le seguenti direttive di esecuzione:
- direttiva 2006/17/CE della Commissione relativa ai requisiti tecnici per la donazione, il reperimento e il controllo di tessuti e cellule umani
- direttiva 2006/86/CE della Commissione relativa ai requisiti di tracciabilità, alla notifica di reazioni ed eventi avversi gravi e determinate prescrizioni tecniche per la codifica, la lavorazione, la conservazione, lo stoccaggio e la distribuzione di tessuti e cellule umani
- direttiva 2015/565 della Commissione che modifica la direttiva 2006/86/CE per quanto riguarda determinate prescrizioni tecniche relative alla codifica di tessuti e cellule umani
- direttiva 2015/566 della Commissione, che attua la direttiva 2004/23/CE, riguarda le procedure per la verifica del rispetto delle norme di qualità e di sicurezza equivalenti di tessuti e cellule importati.
Le decisioni 2010/453/CE della Commissione e la direttiva 2012/39/UE della Commissione, così come la decisione C(2015) 4460 della Commissione affrontano ulteriori aspetti specifici.
È importante notare che i paesi dell'UE possono sempre scegliere di applicare norme più rigorose in materia di qualità e sicurezza dei tessuti e delle cellule rispetto a quelle elencate sopra.
A seguito di una valutazione della legislazione dell'UE in materia di tessuti, cellule e sangue pubblicata nel 2019, la Commissione ha proposto una revisione di tale legislazione, che è stata adotta il 14 luglio 2022.
Coordinamento
Le autorità competenti nazionali sono responsabili dell'attuazione delle disposizioni contenute nella legislazione dell'UE. La Commissione europea si riunisce regolarmente con loro per agevolare la comunicazione, scambiare migliori pratiche e raggiungere un'intesa comune sull'attuazione delle direttive. Sulla base di sondaggi periodici a cura delle autorità competenti, la Commissione elabora relazioni sull'attuazione della legislazione.





