La donación de sangre y componentes sanguíneos (glóbulos rojos, plaquetas y plasma) facilita un amplio abanico de tratamientos esenciales que a menudo salvan vidas. Las transfusiones de sangre son vitales en los casos de traumatismo o cirugía mayor y a menudo necesarias para el tratamiento del cáncer o de enfermedades hematológicas crónicas de carácter hereditario como la talasemia.
El plasma procedente de las donaciones de sangre también puede utilizarse para obtener medicamentos como inmunoglobulinas o factores de coagulación. La elaboración de estos productos está sujeta a la legislación farmacéutica, mientras que la donación, extracción y verificación del plasma se regula por la legislación aplicable a la sangre.
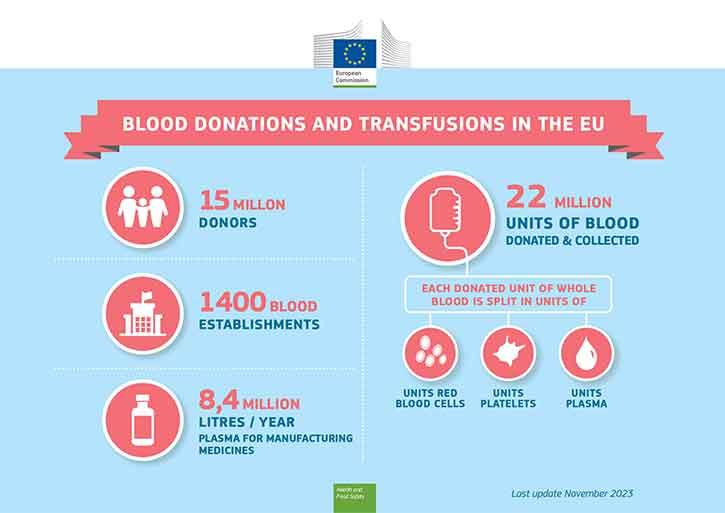
La disponibilidad de sangre y componentes sanguíneos depende de la disposición de los ciudadanos para donar sangre. La mayoría de las personas que gozan de buena salud pueden hacerlo.
La Comisión Europea financia acciones en el ámbito de las sustancias de origen humano, principalmente mediante proyectos o acciones conjuntas con las autoridades nacionales. Las acciones tienen por objeto apoyar el mandato de la UE en materia de seguridad y calidad, pero también pueden servir para fomentar otras prioridades programáticas, como la mejora de la disponibilidad de las SoHO o la eficiencia de los sistemas de salud que apoyan la donación y el suministro.
Legislación
El marco jurídico que define las normas de calidad y seguridad aplicables a la sangre y sus componentes se establece en la Directiva 2002/98/CE, también conocida como Directiva sobre la sangre, que abarca todas las etapas del proceso de transfusión: donación, extracción, verificación, tratamiento, almacenamiento y distribución.
Para facilitar la aplicación de este texto principal, la Comisión Europea propuso y adoptó, en estrecha colaboración con las autoridades nacionales de la UE, los siguientes actos de ejecución:
- Directiva 2004/33/CE de la Comisión sobre los requisitos técnicos aplicables a la sangre y a la donación de sangre
- Directiva 2005/61/CE de la Comisión sobre los requisitos de trazabilidad y las obligaciones de notificación de reacciones y efectos adversos graves
- Directiva 2005/62/CE de la Comisión por la que se establecen normas y especificaciones comunitarias relativas a un sistema de calidad para los centros de transfusión sanguínea
Las Directivas de la Comisión 2009/135/CE, 2011/38/UE, 2014/110/UE y 2016/1214 abordan otros requisitos técnicos específicos.
Es importante señalar que los países de la UE siempre pueden optar por aplicar normas de calidad y seguridad de la sangre y los hemoderivados más estrictas que las indicadas anteriormente.
Como seguimiento de la evaluación de la legislación de la UE sobre sangre y tejidos y células, publicada en 2019, la Comisión propuso una revisión de dicha legislación, que se adoptó el 14 de julio de 2022.
Coordinación
Las autoridades nacionales competentes son responsables de la aplicación de la legislación de la UE. La Comisión Europea organiza reuniones periódicas con ellas para facilitar la comunicación, intercambiar buenas prácticas y llegar a un entendimiento común sobre la aplicación de las Directivas.
Las encuestas periódicas, a cargo de las autoridades nacionales competentes, permiten a la Comisión elaborar informes sobre los avances en cuanto a la aplicación de la legislación.





