Oddawanie krwi i jej składników (czerwonych ciałek krwi, płytek krwi i osocza) umożliwia szereg podstawowych zabiegów, które często mogą uratować życie. Transfuzje krwi są niezbędne w przypadku urazu lub poważnej operacji; często są potrzebne przy leczeniu raka lub dziedzicznych przewlekłych chorób krwi, takich jak talasemia.
Oddane osocze można również wykorzystać do produkcji produktów leczniczych, takich jak immunoglobuliny czy czynniki krzepnięcia krwi. Wytwarzanie tych produktów regulują przepisy farmaceutyczne, natomiast oddawanie, pobieranie i testowanie osocza – przepisy dotyczące krwi.
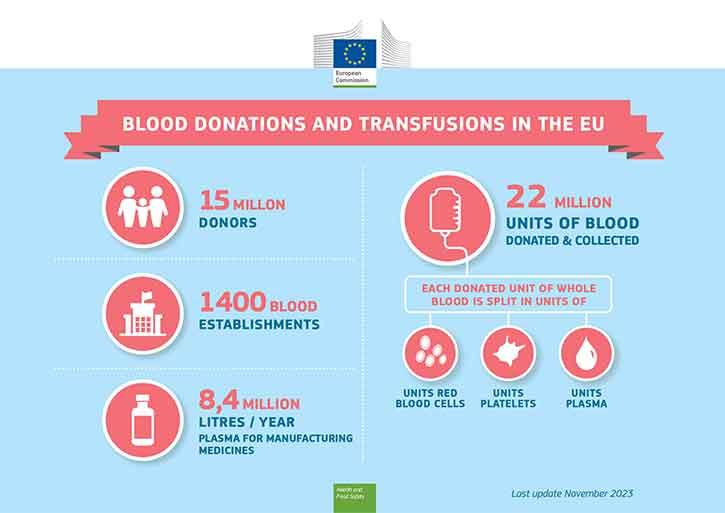
Dostępność krwi i składników krwi zależy od gotowości obywateli do oddawania krwi. Większość osób cieszących się dobrym zdrowiem może oddawać krew.
Komisja Europejska zapewnia finansowanie działań w dziedzinie substancji pochodzenia ludzkiego, głównie w formie projektów lub wspólnych działań podejmowanych z organami krajowymi. Działania mają na celu wsparcie mandatu UE w dziedzinie bezpieczeństwa i jakości, ale mogą też służyć promowaniu innych priorytetów polityki, takich jak poprawa dostępności substancji pochodzenia ludzkiego lub poprawa efektywności systemów zdrowotnych odpowiedzialnych za pobieranie i zapasy.
Przepisy
Ramy prawne określające normy jakości i bezpieczeństwa krwi i jej składników zawarto w dyrektywie 2002/98/WE, zwanej również europejską dyrektywą dotyczącą krwi. W dyrektywie tej uwzględniono wszystkie etapy procesu transfuzji – oddawanie, pobieranie, testowanie, przetwarzanie, przechowywanie i dystrybucję krwi.
Aby pomóc we wdrożeniu tego aktu głównego, Komisja Europejska w ścisłej współpracy z organami krajowymi UE przedstawiła i przyjęła następujące dodatkowe akty wykonawcze:
- dyrektywę Komisji 2004/33/WE w sprawie wymagań technicznych dotyczących krwi i pobierania krwi
- dyrektywę Komisji 2005/61/WE w sprawie wymogów dotyczących śledzenia losów krwi oraz powiadamiania o poważnych, niepożądanych reakcjach i zdarzeniach
- dyrektywę Komisji 2005/62/WE określającą normy i specyfikacje wspólnotowe odnoszące się do systemu jakości obowiązującego w banku krwi.
W dyrektywach Komisji 2009/135/WE, 2011/38/UE, 2014/110/UE, 2016/1214 określono bardziej szczegółowe wymagania techniczne.
Należy zauważyć, że państwa UE w każdej chwili mogą podjąć decyzję o zastosowaniu bardziej rygorystycznych przepisów dotyczących jakości i bezpieczeństwa krwi i produktów krwiopochodnych niż te określone powyżej.
W następstwie oceny przepisów UE dotyczących krwi, tkanek i komórek, opublikowanej w 2019 r., Komisja zaproponowała zmiany w tych przepisach, które zostały przyjęte 14 lipca 2022 r.
Koordynacja
Właściwe organy krajowe odpowiadają za wdrażanie przepisów UE. Komisja Europejska zwołuje regularne posiedzenia z tymi organami, aby ułatwić komunikację, wymieniać najlepsze praktyki oraz wypracować wspólne porozumienie w zakresie wdrażania dyrektyw.
Właściwe organy wypełniają okresowe ankiety, które umożliwiają Komisji sporządzanie projektów sprawozdań ze stanu prac nad wdrażaniem przepisów.





