Blod, vävnader, celler och organ används i många medicinska behandlingar.
De kan rädda liv (t.ex. en blodtransfusion efter en olycka), förbättra livskvaliteten (t.ex. en njurtransplantation) eller skapa nytt liv (ägg- och spermiedonation och in vitro-befruktning).
Trots fördelarna med att använda ämnen av mänskligt ursprung finns det alltid risker, i synnerhet för sjukdomsspridning.
Kommissionen har därför fastställt höga kvalitets- och säkerhetsstandarder i enlighet med sitt uppdrag (artikel 168.4 a i fördraget om Europeiska unionens funktionssätt).
Dessutom arbetar kommissionen med att
- ta fram lagstiftning och riktlinjer
- hjälpa medlemsländernas myndigheter med genomförandet
- övervaka säkerheten och stödja projekt.
Det övergripande målet är att skydda människor.
Nya EU-regler om ämnen av mänskligt ursprung
I maj 2024 antog rådet den nya förordningen om kvalitets- och säkerhetsstandarder för humanbiologiskt material avsett för användning på människa.
Samordningsstyrelsen för humanmaterial, som inrättats genom denna förordning, har i uppdrag att säkerställa enhetliga förfaranden för tillämpningen av denna förordning och annan relevant unionslagstiftning.
Så går hanteringen till
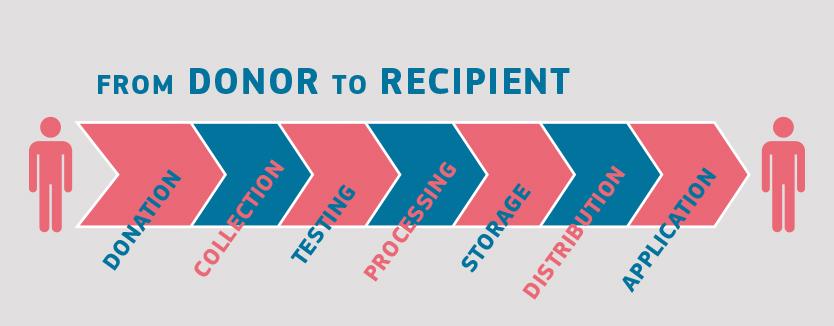
Hanteringen av blod, vävnader, celler och organ följer alltid ungefär samma steg. Den börjar med donation och slutar med klinisk användning. Dessutom ingår tillvaratagande, bearbetning, distribution, testning av givare och ofta förvaring (särskilt för blod, vävnader och celler).
Allt detta görs på särskilda sjukvårdsinrättningar.
Samarbete
Tillsammans med Europarådet och EU:s smittskyddsmyndighet (ECDC) tar kommissionen fram praktiska riktlinjer för att hjälpa blodcentralerna att tillämpa reglerna.
Finansiering
Kommissionen är med och finansierar projekt som rör ämnen av mänskligt ursprung (humanmaterial).
Hälso- och sjukvården är dock ländernas eget ansvar och därför fattas alla beslut om metoder för ämnen av mänskligt ursprung på nationell nivå. Kommissionen har inget inflytande över besluten som kan se olika ut beroende på land.
De metoder som EU-länderna tillåter måste dock tillämpas i enlighet med EU:s krav på säkerhet och kvalitet.
Nationella myndigheter kan också välja att införa ännu strängare säkerhets- och kvalitetskrav, t.ex. ytterligare labbtest vid lokala utbrott av en mycket smittsam sjukdom.
Riktlinjer
Europarådet ser regelbundet över och uppdaterar de tekniska kraven i sina vägledningar och riktlinjer:
- Vägledning för beredning, användning och kvalitetssäkring av blodkomponenter
- Riktlinjer för god praxis för blodcentraler
- Vägledning om kvalitets- och säkerhetskrav för vävnader och celler som ska användas på människor
Europarådet tar också fram riktlinjer om olika aspekter som gäller humanmaterialets säkerhet och kvalitet.
Efter offentliggörandet av den nya förordningen om humanmaterial tar ECDC fram tekniska riktlinjer för förebyggande av överföring av smittsamma sjukdomar genom humanmaterial.
Vid utbrott av infektionssjukdomar som är relevanta för humanmaterial kommer ECDC dessutom att offentliggöra snabba riskbedömningar med råd och rekommendationer för att upprätthålla humanmaterialets mikrobiella säkerhet i samband med dessa händelser. Nyligen publicerade publikationer och uppdateringar om ECDC:s verksamhet med anknytning till humanmaterials mikrobiella säkerhet finns på ECDC:s webbplats:






