Използването на методи за лечение, основаващи се на тъкани и клетки, нараства както по брой на случаите, така и по честота благодарение на значителния напредък на биотехнологиите.
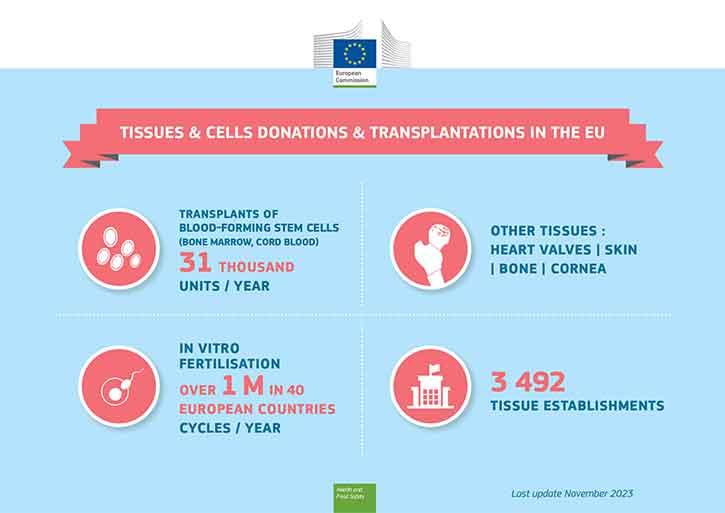
Кръвотворните стволови клетки се трансплантират от донори на костен мозък (или кръв от пъпна връв) на пациенти с рак на кръвта, а гаметите се използват за ин витро оплождане. Това са два вида добре известни терапии, при които се използват човешки клетки. Други изключително важни начини за използване на човешки тъкани са например присаждането на кожа на пострадали от изгаряния или присаждане на роговица за възстановяване на зрението.
Костен мозък (хемопоетични стволови клетки) и гамети (сперма, яйцеклетки) за ин витро оплождане могат да бъдат дарявани само от живи донори, докато заместващи тъкани (като кожа, кости, роговица или сърдечни клапи) могат да се даряват и след смъртта.
Европейската комисия предоставя финансиране за действия във връзка със субстанциите от човешки произход предимно под формата на проекти или съвместни действия с национални органи. Действията имат за цел да се подпомогне изпълнението на ангажимента на ЕС в областта на безопасността и качеството, но също така служат за насърчаване на други политически приоритети, като подобряване на достъпа до субстанции от човешки произход или на ефективността на здравните системи, които подкрепят донорството и предлагането.
Законодателство
Нормативната уредба за определяне на стандартите за качество и безопасност за тъкани и клетки се съдържа в Директива 2004/23/ЕО, приета през 2004 г. от Европейския парламент и Съвета и наричана още Европейска директива относно тъканите и клетките, . Тя обхваща всички стъпки в процеса на трансплантация — даряването, доставянето, контрола, преработването, съхраняването, съхранението и разпределянето.
За да подпомогне прилагането на този основен акт, Комисията предложи и прие — в тясно сътрудничество със страните от ЕС — следните директиви за изпълнение:
- Директива 2006/17/ЕО на Комисията относно някои технически изисквания във връзка с даряването, доставянето и контрола на човешки тъкани и клетки
- Директива 2006/86/ЕО на Комисията относно установяването на изисквания за проследимост, съобщаване на сериозни нежелани реакции и събития и определени технически изисквания по отношение на кодиране, преработване, съхраняване, съхранение и предоставяне на човешки тъкани и клетки
- Директива 2015/565 на Комисията за изменение на Директива 2006/86/ЕО по отношение на някои технически изисквания за кодирането на човешки тъкани и клетки
- Директива 2015/566 на Комисията за прилагане на Директива 2004/23/ЕО по отношение на процедурите за контрол на спазването на еквивалентните стандарти за качество и безопасност на внасяните тъкани и клетки
В Решение 2010/453/ЕО на Комисията и Директива 2012/39/ЕС на Комисията, както и в Решение C(2015) 4460 на Комисията също се разглеждат някои други конкретни аспекти.
Важно е да се отбележи, че страните от ЕС винаги могат да решат да прилагат по-строги правила за качеството и безопасността на тъканите и клетките в сравнение с горепосочените.
След публикуването през 2019 г. на оценка на законодателството на ЕС относно кръвта, тъканите и клетките Комисията предложи преразглеждане на това законодателство. Преработеният текст бе приет на 14 юли 2022 г.
Координация
Компетентните национални органи отговарят за изпълнението на изискванията, определени в законодателството на ЕС. Европейската комисия провежда редовни срещи с тях за улесняване на комуникацията и обмена на добри практики и за установяване на общо разбиране във връзка с прилагането на директивите. Периодично провеждани от компетентните органи проучвания дават възможност на Европейската комисия да изготвя доклади за прилагането на законодателството.






