Počet a četnost použití tkání a buněk při lékařských zákrocích díky významnému pokroku biotechnologií roste.
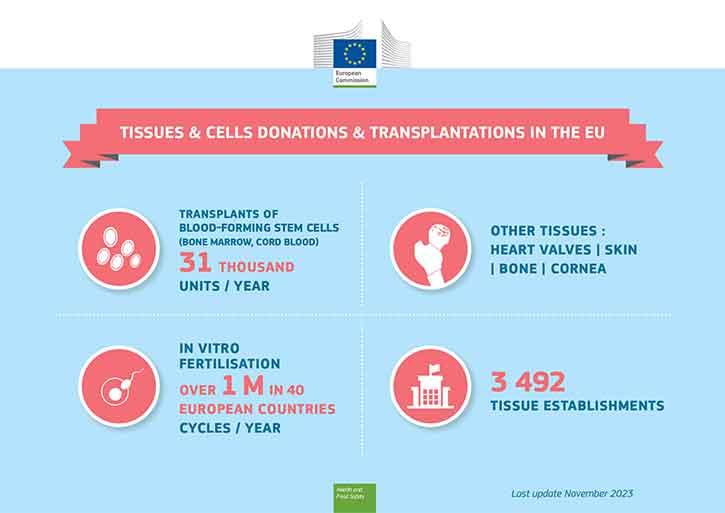
Pacientům s rakovinou se transplantují krvetvorné kmenové buňky z kostní dřeně dárců (nebo pupečníkové krve), k oplodnění in vitro se zase používají gamety. Oba typy léčby využívající lidské buňky jsou již dobře známé. Mezi další neocenitelná využití lidské tkáně patří transplantace kůže u obětí popálenin a transplantace rohovky k obnovení zraku pacienta.
Kostní dřeň (krvetvorné kmenové buňky) a gamety (spermie, vajíčka) k oplodnění in vitro mohou darovat žijící dárci, zatímco tkáň k transplantaci (kůže, kosti, rohovka nebo srdečních chlopně) se daruje po smrti.
Evropská komise poskytuje finanční prostředky na projekty nebo společné akce s vnitrostátními orgány týkající se látek lidského původ. Opatření se zaměřují na podporu mandátu EU týkajícího se bezpečnosti a kvality, ale slouží také k prosazování jiných politických priorit, jako je zlepšování dostupnosti látek lidského původu nebo účinnosti systémů zdravotní péče při podpoře dárcovství a dodávek.
Související právní předpisy
Právní rámec, který definuje normy pro kvalitu a bezpečnost tkání a buněk, stanoví směrnice 2004/23/ES (evropská směrnice o tkáních a buňkách) přijatá v roce 2004 rozhodnutím Evropského parlamentu a Rady. Vztahuje se na všechny jednotlivé kroky transplantačního procesu od darování, odběru, vyšetřování, zpracování, konzervaci, skladování až po distribuci.
S cílem napomoci provádění tohoto základního aktu Komise navrhla a přijala v úzké spolupráci se zeměmi EU tyto prováděcí směrnice:
- směrnice Komise 2006/17/ES týkající se technických požadavků na darování, opatřování a vyšetřování lidských tkání a buněk
- směrnice Komise 2006/86/ES týkající se požadavků na sledovatelnost, oznamování závažných nežádoucích reakcí a účinků a některých technických požadavků na kódování, zpracování, konzervaci, skladování a distribuci lidských tkání a buněk
- směrnice Komise 2015/565, kterou se mění směrnice 2006/86/ES, pokud jde o některé technické požadavky na kódování lidských tkání a buněk
- směrnice Komise 2015/566, kterou se provádí směrnice 2004/23/ES, pokud jde o postupy pro ověřování rovnocenných jakostních a bezpečnostních norem pro dovážené tkáně a buňky
Některé další specifické aspekty upravují rozhodnutí Komise 2010/453/ES a směrnice Komise 2012/39/EU, a dále rozhodnutí Komise C(2015) 4460.
Nadále platí, že země EU mohou dle vlastního uvážení vždy zavést přísnější pravidla na bezpečnost tkání a buněk nad rámec evropských požadavků uvedených výše.
V návaznosti na hodnocení právních předpisů EU týkajících se odebírané krve, tkání a buněk, které bylo zveřejněno v roce 2019, Komise navrhla plán na revizi uvedených předpisů, jenž byl 14. července 2022 přijat.
Koordinace
Za uplatňování požadavků stanovených právními předpisy EU jsou odpovědné příslušné vnitrostátní orgány. Evropská komise pořádá pravidelné schůze s jejich zástupci s cílem usnadnit vzájemnou komunikaci, výměnu osvědčených postupů a dosáhnout společného porozumění ohledně provádění směrnic. Pravidelné průzkumy, které příslušné orgány provádějí, poskytují Komisi podklady pro přípravu zpráv o aktuálním stavu provádění právních předpisů.






