Z napredkom na področju biotehnologije uporaba tkiv in celic za zdravljenje narašča, in sicer tako z vidika števila posegov kot pogostosti.
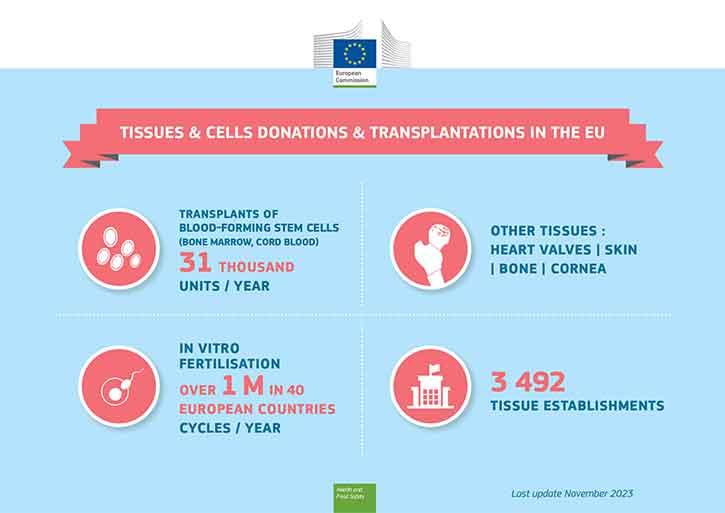
Pri bolnikih s krvnim rakom se uporablja presaditev krvotvornih matičnih celic iz kostnega mozga donatorjev (ali popkovnične krvi), za oploditev in vitro pa se uporabljajo gamnete. Obe vrsti zdravljenja sta znani po tem, da uporabljata človeške celice. Človeška tkiva se uporabljajo tudi pri drugih posegih, denimo presaditvi kože opečenih oseb ali presaditvi roženice cepljenje za povrnitev vida.
Kostni mozeg (krvotvorne matične celice) in gamete (semenčice, jajčne celice) oploditev in vitro lahko darujejo živi darovalci, medtem ko lahko nadomestna tkiva (koža, roženica, kostni mozeg ali srčne zaklopke) darovalcem odvzamejo po njihovi smrti.
Evropska komisija financira ukrepe na področju snovi človeškega izvora v obliki projektov ali skupnih ukrepov nacionalnih organov. Ukrepi so namenjeni podpori nalogam EU na področju varnosti in kakovosti, vendar lahko tudi spodbujajo druge prednostne naloge politike, kot sta izboljšanje razpoložljivosti snovi človeškega izvora in učinkovita podpora zdravstvenih sistemov za darovanje in oskrbo s človeškimi organi.
Zakonodaja
Pravni okvir za opredelitev standardov kakovosti in varnosti za tkiva in celice določa Direktiva 2004/23/ES, imenovana tudi evropska direktiva o tkivih in celicah, ki sta jo sprejela Evropski parlament in Svet EU. Direktiva zajema vse stopnje v postopku presajanja, od darovanja, pridobivanja, testiranja, predelave, konzerviranja, shranjevanja in razdeljevanja.
Za pomoč pri izvajanju tega pomembnega akta je Evropska komisija v tesnem sodelovanju z organi držav članic EU predlagala in sprejela naslednje direktive:
- Direktiva Komisije 2006/17/ES o nekaterih tehničnih zahtevah za darovanje, pridobivanje in testiranje človeških tkiv in celic
- Direktiva Komisije 2006/86/ES o zahtevah glede sledljivosti, obveščanja o hudih in neželenih reakcijah in pojavih ter nekaterih tehničnih zahtevah za kodiranje, predelavo, konzerviranje, shranjevanje in razdeljevanje človeških tkiv in celic
- Direktiva Komisije 2015/565 o spremembi Direktive 2006/86/ES v zvezi z nekaterimi tehničnimi zahtevami za kodiranje človeških tkiv in celic
- Direktiva Komisije 2015/566 o izvajanju Direktive 2004/23/ES v zvezi s postopki za preverjanje ustreznosti standardov kakovosti in varnosti uvoženih tkiv in celic
Sklep Komisije 2010/453/ES, Direktiva Komisije 2012/39/EU in Sklep Komisije C(2015)4460 obravnavajo nekatere posebne vidike.
Pomembno je poudariti, da se lahko države EU vedno odločijo za uporabo strožjih pravil glede kakovosti in varnosti tkiv in celic, kot so zgoraj navedena.
Po oceni zakonodaje EU o krvi, tkivih in celicah, objavljeni leta 2019, je Komisija predlagala spremembo te zakonodaje, ki je bila sprejeta 14. julija 2022.
Usklajevanje
Za izvajanje zahtev iz zakonodaje EU so odgovorni pristojni organi držav članic. Redni sestanki Evropske komisije s predstavniki nacionalnih organov spodbujajo komunikacijo in izmenjavo dobrih praks ter omogočajo skupno razumevanje izvajanja direktiv. Pristojni organi opravljajo redne preglede, kar omogoča Komisiji, da pripravi poročila o izvajanju zakonodaje.






