Znaczące postępy w biotechnologii pozwalają na wykonywanie coraz liczniejszych i coraz częstszych zabiegów medycznych z wykorzystaniem tkanek i komórek.
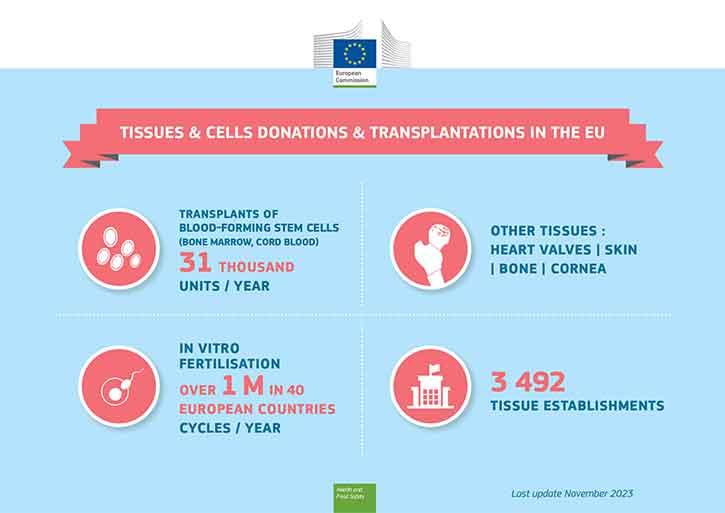
Krwiotwórcze komórki macierzyste przeszczepia się od dawców szpiku kostnego (lub z krwi pępowinowej) pacjentom cierpiącym na raka krwi, natomiast gamety wykorzystuje się w zabiegu zapłodnienia in vitro. Oba zabiegi są dobrze znanymi terapiami medycznymi wykorzystującymi komórki ludzkie. Inne nieocenione zastosowania tkanek ludzkich obejmują przeszczepy skóry dla ofiar poparzeń lub przeszczepy rogówki w celu przywrócenia wzroku.
Szpik kostny (krwiotwórcze komórki macierzyste) i gamety (plemniki, komórki jajowe) wykorzystywane do zapłodnienia in vitro mogą być pobierane od żywych dawców, natomiast tkanki zastępcze (takie jak skóra, kości, rogówka czy zastawki serca) mogą być pobierane po śmierci.
Komisja Europejska finansuje działania w obszarze substancji pochodzenia ludzkiego głównie w formie projektów lub wspólnych działań z organami krajowymi. Działania mają na celu wsparcie mandatu UE w dziedzinie bezpieczeństwa i jakości, ale mogą też służyć promowaniu innych priorytetów polityki, takich jak poprawa dostępności substancji pochodzenia ludzkiego lub poprawa efektywności systemów zdrowotnych odpowiedzialnych za pobieranie i zapasy.
Przepisy
Ramy prawne określające normy bezpieczeństwa i jakości tkanek i komórek zawarto w dyrektywie 2004/23/WE – zwanej również europejską dyrektywą dotyczącą tkanek i komórek – przyjętej w 2004 r. przez Parlament Europejski i Radę. W dyrektywie tej uwzględniono wszystkie etapy procesu przeszczepu – dawstwo, pobieranie, testowanie, przetwarzanie, konserwowanie, przechowywanie i dystrybucję.
Aby pomóc we wdrożeniu tego aktu podstawowego, Komisja w ścisłej współpracy z państwami UE przedstawiła i przyjęła następujące dyrektywy wykonawcze:
- dyrektywę Komisji 2006/17/WE dotyczącą niektórych wymagań technicznych dotyczących dawstwa, pobierania i badania tkanek i komórek ludzkich
- dyrektywę Komisji 2006/86/WE w sprawie wymagań dotyczących możliwości śledzenia, powiadamiania o poważnych i niepożądanych reakcjach i zdarzeniach oraz niektórych wymagań technicznych dotyczących kodowania, przetwarzania, konserwowania, przechowywania i dystrybucji tkanek i komórek ludzkich
- dyrektywę Komisji 2015/565 zmieniająca dyrektywę 2006/86/WE w odniesieniu do niektórych wymagań technicznych dotyczących kodowania tkanek i komórek ludzkich
- dyrektywę Komisji 2015/566 w sprawie wykonania dyrektywy 2004/23/WE w odniesieniu do procedur weryfikacji równorzędnych norm jakości i bezpieczeństwa przywożonych tkanek i komórek.
W decyzji Komisji 2010/453/WE, dyrektywie Komisji 2012/39/UE oraz decyzji Komisji C(2015) 4460 określono bardziej szczegółowe aspekty.
Państwa UE w każdej chwili mogą podjąć decyzję o zastosowaniu bardziej rygorystycznych przepisów dotyczących jakości i bezpieczeństwa tkanek oraz komórek niż te określone powyżej.
W następstwie oceny przepisów UE dotyczących krwi, tkanek i komórek, opublikowanej w 2019 r., Komisja zaproponowała zmiany w tych przepisach, które zostały przyjęte 14 lipca 2022 r.
Koordynacja
Właściwe organy krajowe odpowiadają za wdrażanie wymogów określonych przepisami UE. Komisja Europejska zwołuje regularne posiedzenia z tymi organami, aby ułatwić komunikację, wymieniać najlepsze praktyki oraz wypracować wspólne porozumienie w zakresie wdrażania dyrektyw. Właściwe organy wypełniają okresowe ankiety, które umożliwiają Komisji sporządzanie projektów sprawozdań z wdrażania przepisów.





