A utilização de tecidos e células para tratamentos médicos está a aumentar, tanto em número como em frequência, graças aos avanços significativos no domínio da biotecnologia.
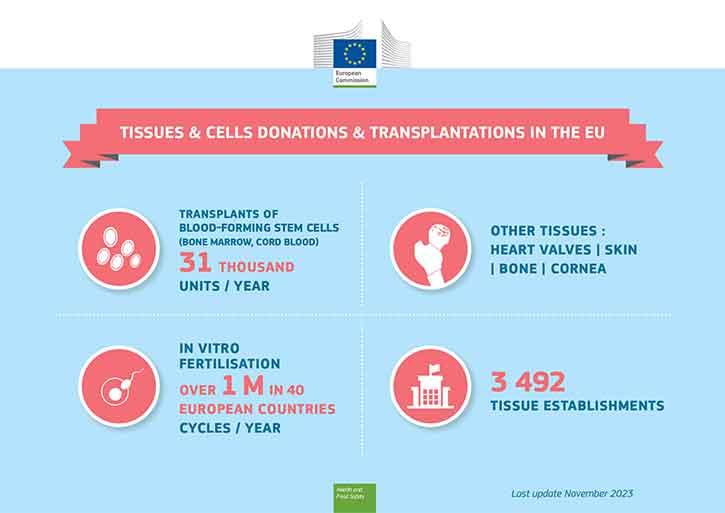
As células estaminais hematopoiéticas provenientes de dadores de medula óssea ou de sangue do cordão umbilical são transplantadas em doentes com leucemia. Os gâmetas são utilizados na fertilização in vitro. Estes são dois exemplos de terapias médicas bem conhecidas que utilizam células humanas. Outras utilizações de tecidos humanos incluem os enxertos de pele em vítimas de queimaduras ou os enxertos de córnea que permitem a recuperação da visão.
A medula óssea (células estaminais hematopoiéticas) e os gâmetas (esperma, óvulos) para a fertilização in vitro podem ser doados por dadores vivos, enquanto que os tecidos de substituição (como a córnea, ossos, pele ou válvulas cardíacas) provêm de dadores post mortem.
A Comissão Europeia disponibiliza financiamento para ações em matéria de substâncias de origem humana (SoHO) principalmente sob a forma de projetos ou ações conjuntas com as autoridades nacionais. As ações destinam-se a apoiar o mandato da UE em matéria de segurança e qualidade, mas podem também servir para promover outras prioridades políticas, tais como a melhoria da disponibilidade de substâncias de origem humana ou a eficiência dos sistemas de saúde que apoiam a dádiva e o aprovisionamento.
Legislação
O quadro jurídico que define as normas de qualidade e segurança para os tecidos e células de origem humana está estabelecido na Diretiva 2004/23/CE (Diretiva Europeia Tecidos e Células), adotada em 2004 pelo Parlamento Europeu e pelo Conselho. Esta diretiva abrange todas as etapas do processo de transplante, da dádiva à distribuição, passando pela colheita, a análise, o processamento, a preservação e o armazenamento.
Para ajudar a executar este ato de base, a Comissão propôs e adotou, em estreita colaboração com os países da UE, as seguintes diretivas de execução:
- Diretiva 2006/17/CE da Comissão relativa a determinados requisitos técnicos aplicáveis à dádiva, colheita e análise de tecidos e células de origem humana
- Diretiva 2006/86/CE da Comissão relativa aos requisitos de rastreabilidade, à notificação de reações e incidentes adversos graves e a determinados requisitos técnicos para a codificação, processamento, preservação, armazenamento e distribuição de tecidos e células de origem humana
- Diretiva 2015/565 da Comissão, que altera a Diretiva 2006/86/CE no que se refere a certos requisitos técnicos para a codificação dos tecidos e células de origem humana
- Diretiva 2015/566 da Comissão que aplica a Diretiva 2004/23/CE no que diz respeito aos procedimentos de verificação da equivalência das normas de qualidade e segurança dos tecidos e células importados
A Decisão 2010/453/CE da Comissão e a Diretiva 2012/39/UE da Comissão, bem como a Decisão C(2015) 4460 da Comissão, tratam alguns aspetos específicos complementares.
É de assinalar que os países da UE podem sempre optar pela aplicação de normas mais rigorosas do que as acima referidas em matéria de qualidade e segurança dos tecidos e células.
Na sequência de uma avaliação da legislação da UE relativa ao sangue e aos tecidos e células, publicada em 2019, a Comissão propôs uma revisão desta legislação, que foi adotada em 14 de julho de 2022.
Coordenação
As autoridades nacionais competentes são responsáveis pela aplicação dos requisitos estabelecidos na legislação da UE. A Comissão Europeia organiza regularmente reuniões com as referidas autoridades para facilitar a comunicação, proceder ao intercâmbio de boas práticas e chegar a um entendimento comum sobre a aplicação das diretivas. As autoridades nacionais competentes respondem a inquéritos periódicos com base nos quais a Comissão Europeia prepara relatórios em que faz o ponto da situação da aplicação da legislação.






