Tänu biotehnoloogia märkimisväärsele arengule on koe- ja rakupõhiseid ravimeetodeid järjest rohkem ja neid kasutatakse aina sagedamini.
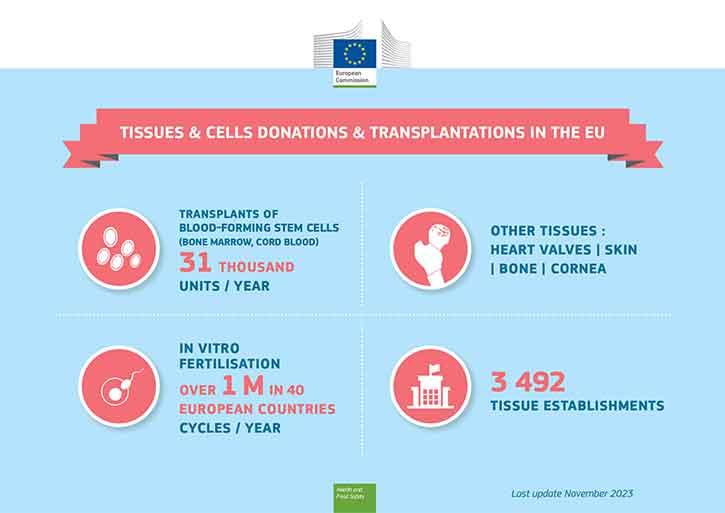
Vereloome tüvirakke siirdatakse luuüdi (või nabaväädivere) doonoritelt verevähihaigetele ning sugurakke kasutatakse kehaväliseks viljastamiseks. Mõlemad need on tunnustatud inimrakupõhised ravimeetodid. Peale selle on veel teisigi väärtuslikke inimkoepõhiseid meetodeid, nagu naha siirdamine põletushaavade ravis ja sarvkesta siirdamine nägemise taastamiseks.
Luuüdi ehk vereloome tüvirakke ja kehaväliseks viljastamiseks vajalikke sugurakke (sperma, munarakud) annetavad elusdoonorid, samas koesiirikuid (nt nahk, luud, sarvkest või südameklapid) saab annetada alles pärast doonori surma.
Euroopa Komisjon rahastab inimpäritolu ainete alaseid meetmeid peamiselt projektide või koos riikide ametiasutustega võetavate ühismeetmete raames. Meetmete eesmärk on toetada ELi kohustuste täitmist ohutuse ja kvaliteedi valdkonnas, kuid need aitavad saavutada ka muid poliitilisi prioriteete, nagu inimpäritolu ainete kättesaadavuse parandamine või annetamist ja tarnet toetavate tervisesüsteemide tõhustamine.
Õigusaktid
Inimkudede ja -rakkude kvaliteedi- ja ohutusnõuete õigusraamistik on kehtestatud Euroopa Parlamendi ja nõukogu poolt 2004. aastal vastu võetud direktiiviga 2004/23/EÜ, mida nimetatakse ka Euroopa inimkudede ja -rakkude direktiiviks. Sellega reguleeritakse kõiki siirdamise etappe alates annetamisest, hankimisest, uurimisest, töötlemisest, säilitamisest ja ladustamisest kuni jaotamiseni.
Direktiivi kui põhiakti rakendamise hõlbustamiseks on komisjon teinud ELi riikidega tihedat koostööd ning vastu võtnud järgmised rakendusaktid:
- komisjoni direktiiv 2006/17/EÜ, milles käsitletakse teatavaid inimkudede ja -rakkude annetamise, hankimise ja uurimise tehnilisi nõudeid;
- komisjoni direktiiv 2006/86/EÜ, milles käsitletakse jälgitavusnõudeid, rasketest kõrvaltoimetest ja tõsistest kõrvalekalletest teatamist ning inimkudede ja -rakkude kodeerimise, töötlemise, säilitamise, ladustamise ja jaotamise tehnilisi lisanõudeid;
- komisjoni direktiiv (EL) 2015/565, millega muudetakse direktiivi 2006/86/EÜ seoses teatavate tehniliste nõuetega inimkudede ja -rakkude kodeerimisele;
- komisjoni direktiiv 2015/566, millega rakendatakse direktiivi 2004/23/EÜ seoses imporditud kudede ja rakkude kvaliteedi- ja ohutusstandardite samaväärsuse kontrollimise menetlustega.
Teatavaid lisaaspekte käsitletakse komisjoni otsustes 2010/453/EÜ ja C(2015) 4460 ning komisjoni direktiivis 2012/39/EL.
Oluline on silmas pidada, et ELi riigid võivad alati otsustada kohaldada ülaltoodutest rangemaid kudede ja rakkude kvaliteedi- ja ohutusnõudeid.
Pärast verd, kudesid ja rakke käsitlevate ELi õigusaktide hindamist, mille tulemused avaldati 2019. aastal, esitas komisjon ettepaneku õigusakti läbivaatamise kohta ning ettepanek võeti vastu 14. juulil 2022.
Koordineerimine
ELi õigusaktidega sätestatud nõuete rakendamise eest vastutavad riikide pädevad asutused. Euroopa Komisjon kohtub nendega korrapäraselt, et hõlbustada teabevahetust, vahetada häid tavasid ning jõuda direktiivide rakendamise üksikasjades ühisele seisukohale. Pädevate asutuste korrapäraselt korraldatavad küsitlused võimaldavad Euroopa Komisjonil nende õigusaktide rakendamise aruandeid koostada.





