Spenden von Blut und Blutbestandteilen (rote Blutkörperchen, Blutplättchen und Plasma) unterstützen eine Vielzahl häufig lebensrettender Behandlungsverfahren. Bluttransfusionen sind unverzichtbar bei der Behandlung von größeren Verletzungen oder chirurgischen Eingriffen und sind häufig erforderlich in der Krebsbehandlung oder der Behandlung chronischer Blutkrankheiten wie des Cooley-Syndroms.
Gespendetes Plasma, ein Blutbestandteil, kann auch zur Herstellung von Arzneimitteln wie Immunglobulin oder Gerinnungsfaktoren verwendet werden. Die Herstellung dieser Erzeugnisse unterliegt dem Arzneimittelrecht, die Spende, Gewinnung und Testung von Plasma den Rechtsvorschriften für Blut.
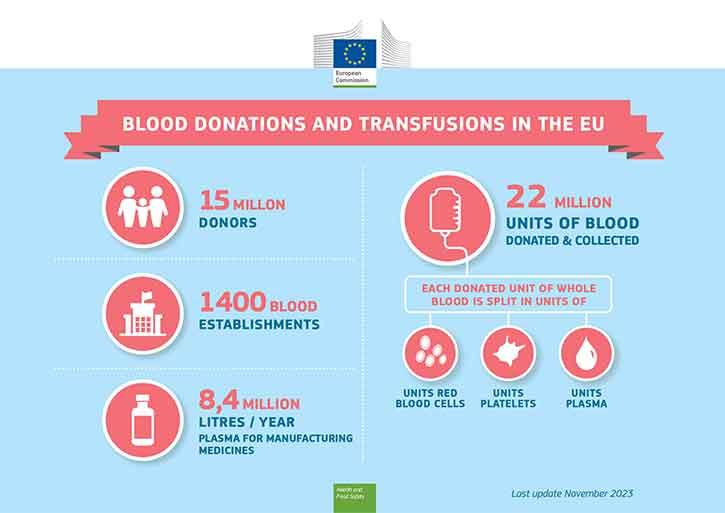
Die Verfügbarkeit von Blut und Blutbestandteilen ist abhängig von der Bereitschaft der Bürgerinnen und Bürger zur Blutspende. Die meisten gesunden Menschen sind in der Lage, Blut zu spenden.
Die Europäische Kommission stellt insbesondere in Form von Projekten oder gemeinsamen Aktionen mit den nationalen Behörden Finanzmittel für Maßnahmen im Bereich der Substanzen menschlichen Ursprungs bereit. Mit den Maßnahmen wird die Verpflichtung der EU zu Sicherheit und Qualität gestützt, es können aber auch andere politische Prioritäten unterstützt werden, etwa eine bessere Verfügbarkeit von Substanzen menschlichen Ursprungs oder eine höhere Effizienz der Gesundheitssysteme, die Anreize für Spende und Bereitstellung schaffen.
Rechtsvorschriften
Rechtsrahmen zur Festlegung der Qualitäts- und Sicherheitsstandards für Blut und Blutbestandteile ist die Richtlinie 2002/98/EG, auch EU-Blutrichtlinie genannt. Sie regelt alle Schritte der Transfusion - von der Spende, der Gewinnung, Testung und Verarbeitung bis hin zur Lagerung und Verteilung.
Zur Umsetzung dieses Basisrechtsakts hat die Kommission in enger Zusammenarbeit mit nationalen Behörden in der EU die nachstehenden Durchführungsrechtsakte vorgeschlagen und angenommen:
- Richtlinie 2004/33/EG der Kommission über die technischen Anforderungen für Blut und Blutbestandteile,
- Richtlinie 2005/61/EG der Kommission über die Anforderungen an die Rückverfolgbarkeit und die Meldung ernster Zwischenfälle und ernster unerwünschter Reaktionen,
- Richtlinie 2005/62/EG der Kommission über gemeinschaftliche Standards und Spezifikationen für ein Qualitätssystem für Blutspendeeinrichtungen.
Die Richtlinien 2009/135/EG, 2011/38/EU, 2014/110/EU und (EU) 2016/1214 haben einige weitere technische Anforderungen zum Gegenstand.
Hierbei ist zu beachten, dass die EU-Mitgliedstaaten grundsätzlich auch strengere Vorschriften für die Qualität und Sicherheit von Blut und Blutprodukten anwenden können, als in den obigen Rechtsakten vorgesehen.
Im Anschluss an eine 2019 veröffentlichte Bewertung der EU-Rechtsvorschriften über Blut, Gewebe und Zellen hat die Kommission eine Überarbeitung dieser Vorschriften vorgeschlagen, die am 14. Juli angenommen wurde.
Koordinierung
Die Durchführung der EU-Rechtsvorschriften ist Aufgabe der zuständigen Behörden der Mitgliedstaaten. Die Europäischen Kommission trifft sich regelmäßig mit diesen Behörden, um den Informationsaustausch zu verbessern, bewährte Verfahren auszutauschen und Übereinstimmung in der Auslegung von Richtlinien zu erzielen.
Auf der Grundlage regelmäßiger Umfragen bei den einzelstaatlichen Behörden erstellt die Europäische Kommission Berichte über den Stand der Durchführung der Rechtsvorschriften.





