As dádivas de sangue e dos seus componentes (glóbulos vermelhos, plaquetas, plasma) facilitam uma grande variedade de tratamentos fundamentais, que muitas vezes salvam vidas. As transfusões de sangue são essenciais quando se trata de traumatismos ou intervenções cirúrgicas importantes e são frequentemente necessárias para o tratamento do cancro ou de doenças crónicas e hereditárias como a talassemia.
As doações de plasma, um componente sanguíneo, podem também ser utilizadas para fabricar medicamentos como as imunoglobulinas ou os coagulantes. O fabrico destes produtos está sujeito à legislação farmacêutica, enquanto a dádiva, a colheita e a análise do plasma são reguladas pela legislação relativa ao sangue.
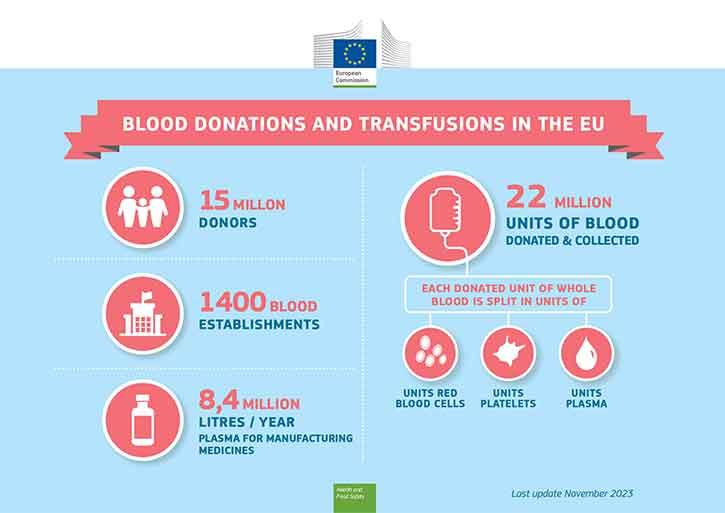
Para garantir a disponibilidade de sangue e dos seus componentes, é fundamental que os cidadãos deem sangue. A maioria das pessoas saudáveis pode doar sangue.
A Comissão Europeia disponibiliza financiamento para ações em matéria de substâncias de origem humana (SoHO) principalmente sob a forma de projetos ou ações conjuntas com as autoridades nacionais. As ações destinam-se a apoiar o mandato da UE em matéria de segurança e qualidade, mas podem também servir para promover outras prioridades políticas, tais como a melhoria da disponibilidade de substâncias de origem humana ou a eficiência dos sistemas de saúde que apoiam a dádiva e o aprovisionamento.
Legislação
O quadro jurídico que define as normas de qualidade e segurança para o sangue e os componentes sanguíneos está estabelecido na Diretiva 2002/98/CE (Diretiva Europeia do Sangue). Esta diretiva abrange todas as etapas do processo de transfusão, da dádiva à distribuição, passando pela colheita, a análise, o processamento e o armazenamento.
Para ajudar a executar este ato principal, a Comissão Europeia propôs e adotou, em estreita colaboração com as autoridades nacionais da UE, os seguintes atos de execução complementares:
- Diretiva 2004/33/CE da Comissão, sobre as exigências técnicas relativas ao sangue e à dádiva de sangue
- Diretiva 2005/61/CE da Comissão, relativa aos requisitos de rastreabilidade e às responsabilidades em matéria de notificação de reações e incidentes adversos graves
- Diretiva 2005/62/CE da Comissão, que estabelece normas e especificações comunitárias relativas ao sistema de qualidade dos serviços de sangue
As Diretivas 2009/135/CE, 2011/38/UE, 2014/110/UE e 2016/1214 da Comissão tratam alguns requisitos técnicos específicos complementares.
É de assinalar que os países da UE podem sempre optar pela aplicação de normas mais rigorosas do que as acima referidas em matéria de qualidade e segurança do sangue e dos produtos derivados do sangue.
Na sequência de uma avaliação da legislação da UE relativa ao sangue e aos tecidos e células, publicada em 2019, a Comissão propôs uma revisão desta legislação, que foi adotada em 14 de julho de 2022.
Coordenação
As autoridades nacionais competentes são responsáveis pela aplicação da legislação da UE. A Comissão Europeia organiza regularmente reuniões com as referidas autoridades para facilitar a comunicação, proceder ao intercâmbio de boas práticas e chegar a um entendimento comum sobre a aplicação das diretivas.
As autoridades nacionais competentes respondem a inquéritos periódicos com base nos quais a Comissão prepara relatórios em que faz o ponto da situação da aplicação da legislação.






