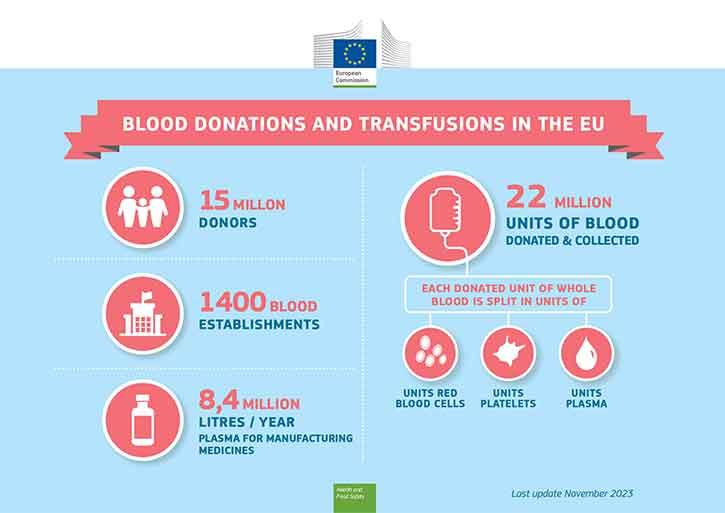
Le donazioni di sangue e dei suoi componenti (globuli rossi, piastrine e plasma) agevolano un'ampia gamma di terapie indispensabili e spesso salvavita. Le trasfusioni di sangue sono essenziali in caso di traumi o interventi chirurgici delicati e si rivelano spesso necessarie nella gestione di malattie tumorali o per il trattamento di malattie ereditarie croniche del sangue, come la talassemia.
Le donazioni di plasma, un componente del sangue, possono anche essere utilizzate per la produzione di medicinali, ad esempio immunoglobuline o fattori coagulanti. La fabbricazione di questi prodotti è soggetta alla legislazione farmaceutica, mentre la donazione, la raccolta e il controllo del plasma sono disciplinati dalla legislazione sul sangue.
La disponibilità del sangue e dei suoi componenti dipende dalla volontà dei cittadini di donare il sangue. Può donare sangue la maggior parte delle persone in buona salute.
Nel campo delle sostanze di origine umana, la Commissione europea eroga finanziamenti prevalentemente per progetti o azioni comuni con le autorità nazionali. Le azioni puntano a sostenere il mandato dell'UE in materia di sicurezza e qualità, ma possono anche promuovere altre priorità strategiche, come migliorare la disponibilità di sostanze di origine umana o l'efficienza dei sistemi sanitari che sostengono la donazione e l'approvvigionamento.
Normativa
Il quadro giuridico che definisce le norme di qualità e di sicurezza relative al sangue e ai suoi componenti è definito nella direttiva 2002/98/CE, nota anche come "direttiva sul sangue". La direttiva riguarda tutte le fasi del processo di trasfusione: donazione, raccolta, controllo, trattamento e stoccaggio, fino alla distribuzione.
Per contribuire all'attuazione di questo atto legislativo principale, la Commissione europea ha proposto e adottato, in stretta collaborazione con le autorità dei paesi dell'UE, i seguenti atti di esecuzione:
- direttiva 2004/33/CE della Commissione relativa ai requisiti tecnici del sangue e degli emocomponenti e delle donazioni
- direttiva 2005/61/CE della Commissione sulle prescrizioni in tema di rintracciabilità e la notifica di effetti indesiderati ed incidenti gravi
- direttiva 2005/62/CE della Commissione che stabilisce le norme e le specifiche comunitarie relative a un sistema di qualità per la banca del sangue.
Le direttive 2009/135/CE, 2011/38/UE, 2014/110/UE, 2016/1214 della Commissione riguardano alcuni requisiti tecnici specifici supplementari.
È importante notare che i paesi dell'UE possono sempre scegliere di applicare norme più rigorose in materia di qualità e sicurezza del sangue e degli emoderivati rispetto a quelle elencate sopra.
A seguito di una valutazione della legislazione dell'UE in materia di tessuti, cellule e sangue pubblicata nel 2019, la Commissione ha proposto una revisione di tale legislazione, che è stata adotta il 14 luglio 2022.
Coordinamento
Le autorità competenti nazionali sono responsabili dell'attuazione della legislazione dell'UE. La Commissione europea si riunisce regolarmente con loro per agevolare la comunicazione, scambiare migliori pratiche e raggiungere un'intesa comune sull'attuazione delle direttive.
Sulla base di sondaggi periodici a cura delle autorità competenti, la Commissione elabora relazioni sullo stato di avanzamento dell'attuazione della legislazione.
Interventi per contrastare la pandemia di COVID-19
La pandemia di COVID-19 ha rappresentato una vera e propria sfida per la salute pubblica. Al fine di conseguire una risposta migliore e più coordinata alla pandemia:
- la Commissione europea ha sostenuto i servizi trasfusionali per aumentare la raccolta di plasma da pazienti convalescenti COVID-19
- l'ECDC ha pubblicato un aggiornamento degli orientamenti sul COVID-19 e le sostanze di origine umana
- la DG SANTE ha pubblicato una serie di orientamenti sulla raccolta e la trasfusione di plasma da pazienti convalescenti COVID-19
- la Commissione europea ha chiarito che le sostanze di origine umana (SoHO) sono considerate beni/servizi essenziali, per i quali la libera circolazione all'interno dell'UE è fondamentale.






